著名医師による解説が無料で読めます
すると翻訳の精度が向上します
最近のX線構造情報に基づいて、推定活性部位の残基(H54、F60、Q111、F113、およびH126)の残基を含むヒトシクロフィリンA(HCYPA)の6つの部位指向変異体が構築され、過剰発現、過剰発現、大腸菌から均一性に精製されました。タンパク質W121A(Liu、J.、Chen、C.-M。、&Walsh、C.T.、1991a、Biochemistry 30、2306-2310)、H54Q、R55A、F60A、Q111A、F113A、およびH126Qは、CIS-Transansedについてアセルスされました。CSAの存在下での免疫抑制薬シクロスポリンA(CSA)およびタンパク質ホスファターゼ2B(カルシニューリン)阻害を結合する能力、ペプチジル - プロリルイソメラーゼ(PPIASE)活性。結果は、H54Q、Q111A、F113A、およびW121Aが野生型組換えHCYPAの触媒効率(KCAT/km)の3-15%を保持していることを示しています。残りの3つの変異体(R55A、F60A、およびH126Q)はそれぞれ、野生型触媒効率の1%未満を保持しており、PPIase触媒にこれらの残基による関与を示しています。CSAアフィニティマトリックスに結合した各変異体。変異体R55A、F60A、F113A、およびH126QはCSAの存在下でカルシヌーリンを阻害しましたが、W121Aはそうではありませんでした。CSAはPPIase活性の競合阻害剤ですが、酵素的に不活性なシクロフィリンと複合し、カルシニューリンのホスファターゼ活性を阻害する可能性があります。
最近のX線構造情報に基づいて、推定活性部位の残基(H54、F60、Q111、F113、およびH126)の残基を含むヒトシクロフィリンA(HCYPA)の6つの部位指向変異体が構築され、過剰発現、過剰発現、大腸菌から均一性に精製されました。タンパク質W121A(Liu、J.、Chen、C.-M。、&Walsh、C.T.、1991a、Biochemistry 30、2306-2310)、H54Q、R55A、F60A、Q111A、F113A、およびH126Qは、CIS-Transansedについてアセルスされました。CSAの存在下での免疫抑制薬シクロスポリンA(CSA)およびタンパク質ホスファターゼ2B(カルシニューリン)阻害を結合する能力、ペプチジル - プロリルイソメラーゼ(PPIASE)活性。結果は、H54Q、Q111A、F113A、およびW121Aが野生型組換えHCYPAの触媒効率(KCAT/km)の3-15%を保持していることを示しています。残りの3つの変異体(R55A、F60A、およびH126Q)はそれぞれ、野生型触媒効率の1%未満を保持しており、PPIase触媒にこれらの残基による関与を示しています。CSAアフィニティマトリックスに結合した各変異体。変異体R55A、F60A、F113A、およびH126QはCSAの存在下でカルシヌーリンを阻害しましたが、W121Aはそうではありませんでした。CSAはPPIase活性の競合阻害剤ですが、酵素的に不活性なシクロフィリンと複合し、カルシニューリンのホスファターゼ活性を阻害する可能性があります。
Based on recent X-ray structural information, six site-directed mutants of human cyclophilin A (hCyPA) involving residues in the putative active site--H54, R55, F60, Q111, F113, and H126--have been constructed, overexpressed, and purified from Escherichia coli to homogeneity. The proteins W121A (Liu, J., Chen, C.-M., & Walsh, C.T., 1991a, Biochemistry 30, 2306-2310), H54Q, R55A, F60A, Q111A, F113A, and H126Q were assayed for cis-trans peptidyl-prolyl isomerase (PPIase) activity, their ability to bind the immunosuppressive drug cyclosporin A (CsA), and protein phosphatase 2B (calcineurin) inhibition in the presence of CsA. Results indicate that H54Q, Q111A, F113A, and W121A retain 3-15% of the catalytic efficiency (kcat/Km) of wild-type recombinant hCyPA. The remaining three mutants (R55A, F60A, and H126Q) each retain less than 1% of the wild-type catalytic efficiency, indicating participation by these residues in PPIase catalysis. Each of the mutants bound to a CsA affinity matrix. The mutants R55A, F60A, F113A, and H126Q inhibited calcineurin in the presence of CsA, whereas W121A did not. Although CsA is a competitive inhibitor of PPIase activity, it can complex with enzymatically inactive cyclophilins and inhibit the phosphatase activity of calcineurin.
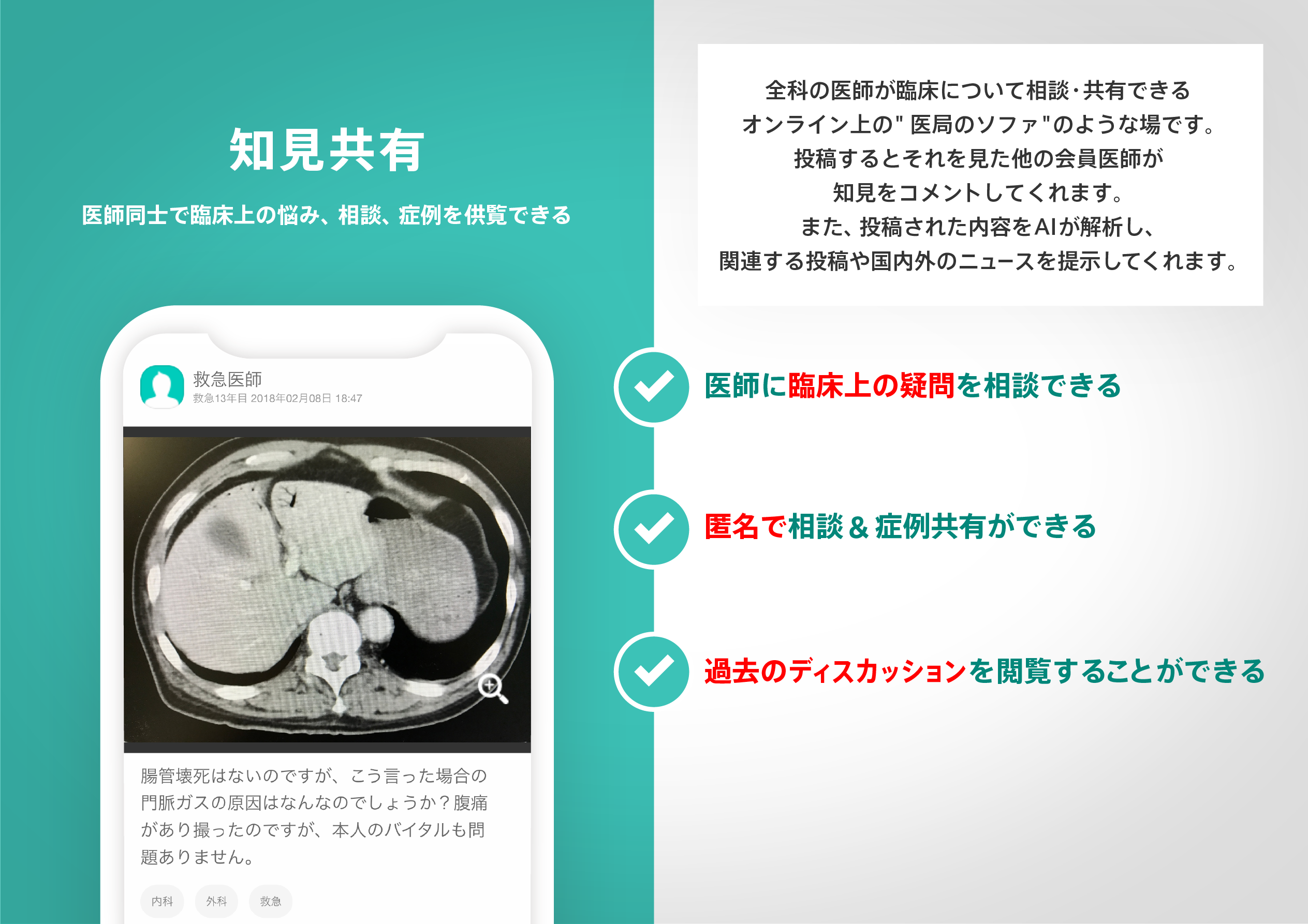
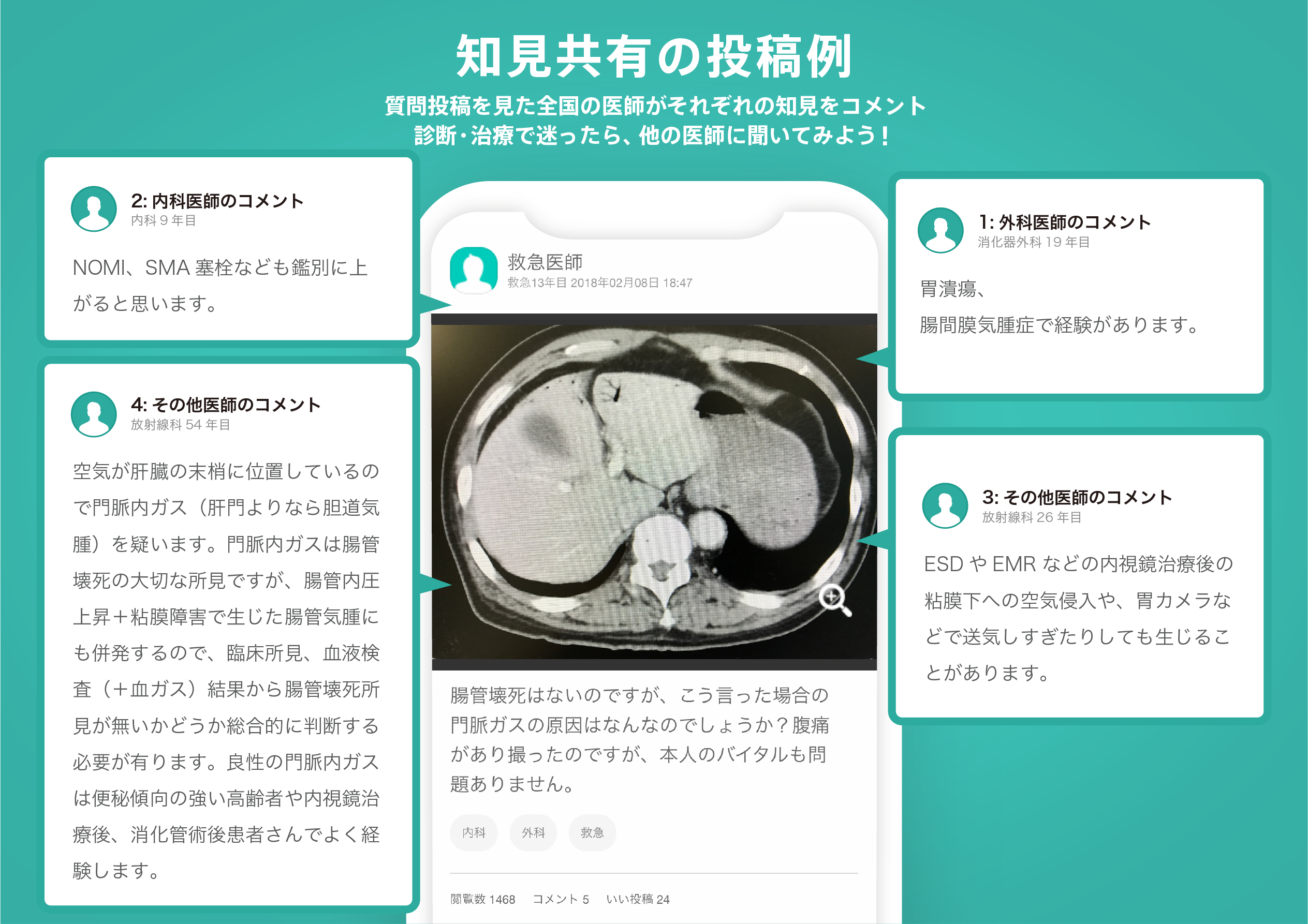
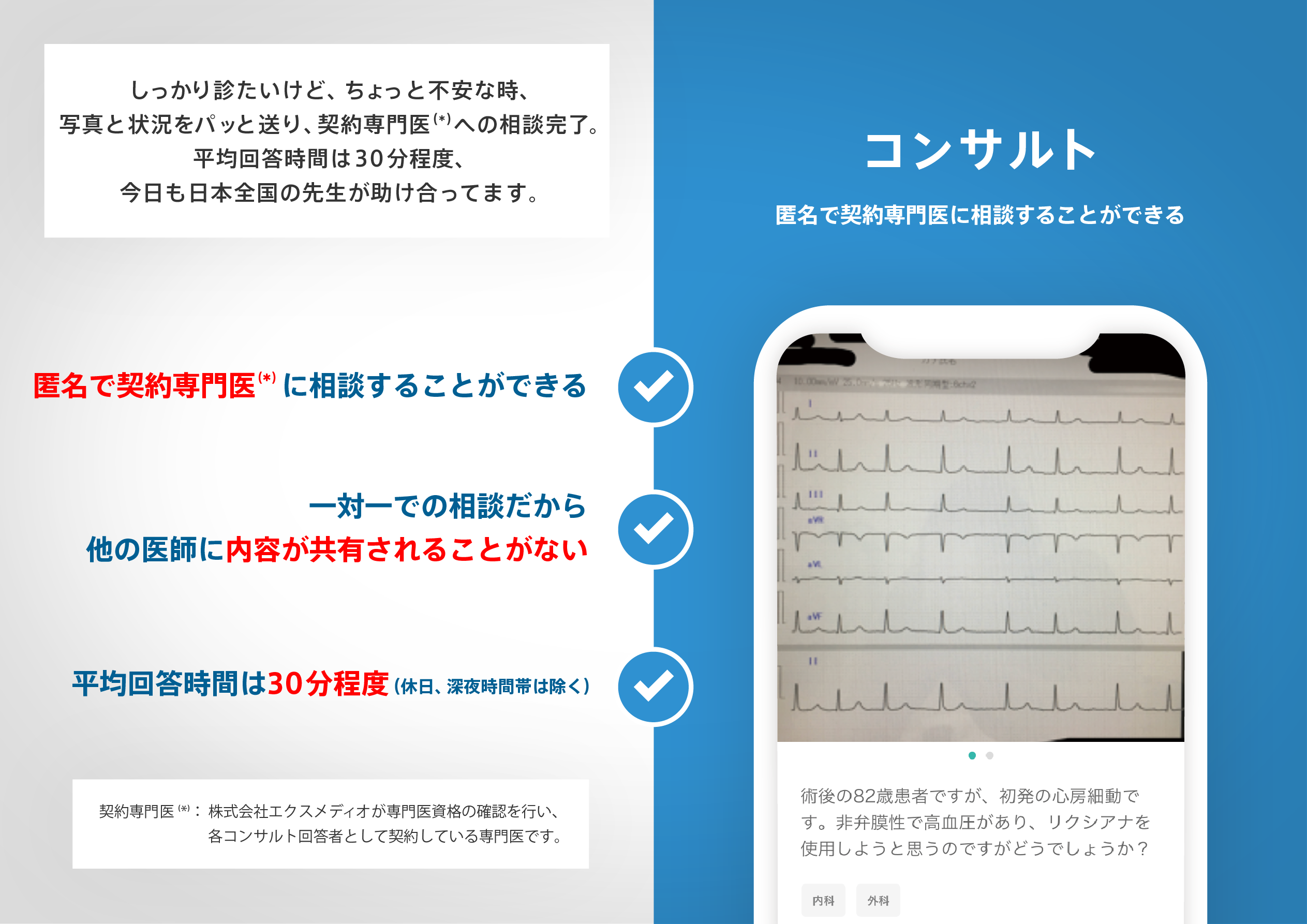
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。