著名医師による解説が無料で読めます
すると翻訳の精度が向上します
可逆的タンパク質アセチル化は、多様な細胞プロセスを迅速に制御するための遍在的な手段です。アセチルトランスフェラーゼ酵素は、アセチル基をアセチルCoAからリジン残基に伝達しますが、脱アセチルゼ酵素は加水分解またはNAD(+)依存反応によりアセチル基の除去を触媒します。アセチルCoAのように、プロピオニル - コエンザイムA(COA)は、脂肪酸代謝の高エネルギー生成物であり、同様の化学反応によって生成されます。アセチルCoAはタンパク質アセチル化のドナー分子であるため、プロピオニルCoAをドナー分子として使用して、タンパク質をin vivoでプロピオニル化できるかどうかを調査しました。サルモネラエンティカプロピオニルCoAシンテターゼ酵素PRPEは、リジン592でin vivoでプロピオニル化されていると報告しています。プロピオニル化はPRPEを不活性化します。プロピオニル - リジン修飾は、細菌のGCN-5関連N-アセチルトランスフェラーゼ酵素によって導入され、細菌およびヒトSIR2酵素(サーチュイン)によって除去される可能性があります。サーチュインの脱アセチル化反応のように、サーチュン触媒のデポピオン化はNAD(+) - 副産物、O-プロピオニルADP-リボースを生成し、脱アセチル化のO-アセチルADP-リボースサーチン生成物に類似しています。脱アセチルゼ活性を持つヒトサーチュインのサブセットのみも、基質を脱プロピオン酸塩酸塩を除去することができました。Acetyl-CoAシンテターゼのアセチル化によるアセチルCoAの調節と、プロピオニル化が高等生物の調節修正として役立つ可能性を高めるPRPEのプロピオニル化による細胞プロピオニルCoAの調節。
可逆的タンパク質アセチル化は、多様な細胞プロセスを迅速に制御するための遍在的な手段です。アセチルトランスフェラーゼ酵素は、アセチル基をアセチルCoAからリジン残基に伝達しますが、脱アセチルゼ酵素は加水分解またはNAD(+)依存反応によりアセチル基の除去を触媒します。アセチルCoAのように、プロピオニル - コエンザイムA(COA)は、脂肪酸代謝の高エネルギー生成物であり、同様の化学反応によって生成されます。アセチルCoAはタンパク質アセチル化のドナー分子であるため、プロピオニルCoAをドナー分子として使用して、タンパク質をin vivoでプロピオニル化できるかどうかを調査しました。サルモネラエンティカプロピオニルCoAシンテターゼ酵素PRPEは、リジン592でin vivoでプロピオニル化されていると報告しています。プロピオニル化はPRPEを不活性化します。プロピオニル - リジン修飾は、細菌のGCN-5関連N-アセチルトランスフェラーゼ酵素によって導入され、細菌およびヒトSIR2酵素(サーチュイン)によって除去される可能性があります。サーチュインの脱アセチル化反応のように、サーチュン触媒のデポピオン化はNAD(+) - 副産物、O-プロピオニルADP-リボースを生成し、脱アセチル化のO-アセチルADP-リボースサーチン生成物に類似しています。脱アセチルゼ活性を持つヒトサーチュインのサブセットのみも、基質を脱プロピオン酸塩酸塩を除去することができました。Acetyl-CoAシンテターゼのアセチル化によるアセチルCoAの調節と、プロピオニル化が高等生物の調節修正として役立つ可能性を高めるPRPEのプロピオニル化による細胞プロピオニルCoAの調節。
Reversible protein acetylation is a ubiquitous means for the rapid control of diverse cellular processes. Acetyltransferase enzymes transfer the acetyl group from acetyl-CoA to lysine residues, while deacetylase enzymes catalyze removal of the acetyl group by hydrolysis or by an NAD(+)-dependent reaction. Propionyl-coenzyme A (CoA), like acetyl-CoA, is a high energy product of fatty acid metabolism and is produced through a similar chemical reaction. Because acetyl-CoA is the donor molecule for protein acetylation, we investigated whether proteins can be propionylated in vivo, using propionyl-CoA as the donor molecule. We report that the Salmonella enterica propionyl-CoA synthetase enzyme PrpE is propionylated in vivo at lysine 592; propionylation inactivates PrpE. The propionyl-lysine modification is introduced by bacterial Gcn-5-related N-acetyltransferase enzymes and can be removed by bacterial and human Sir2 enzymes (sirtuins). Like the sirtuin deacetylation reaction, sirtuin-catalyzed depropionylation is NAD(+)-dependent and produces a byproduct, O-propionyl ADP-ribose, analogous to the O-acetyl ADP-ribose sirtuin product of deacetylation. Only a subset of the human sirtuins with deacetylase activity could also depropionylate substrate. The regulation of cellular propionyl-CoA by propionylation of PrpE parallels regulation of acetyl-CoA by acetylation of acetyl-CoA synthetase and raises the possibility that propionylation may serve as a regulatory modification in higher organisms.
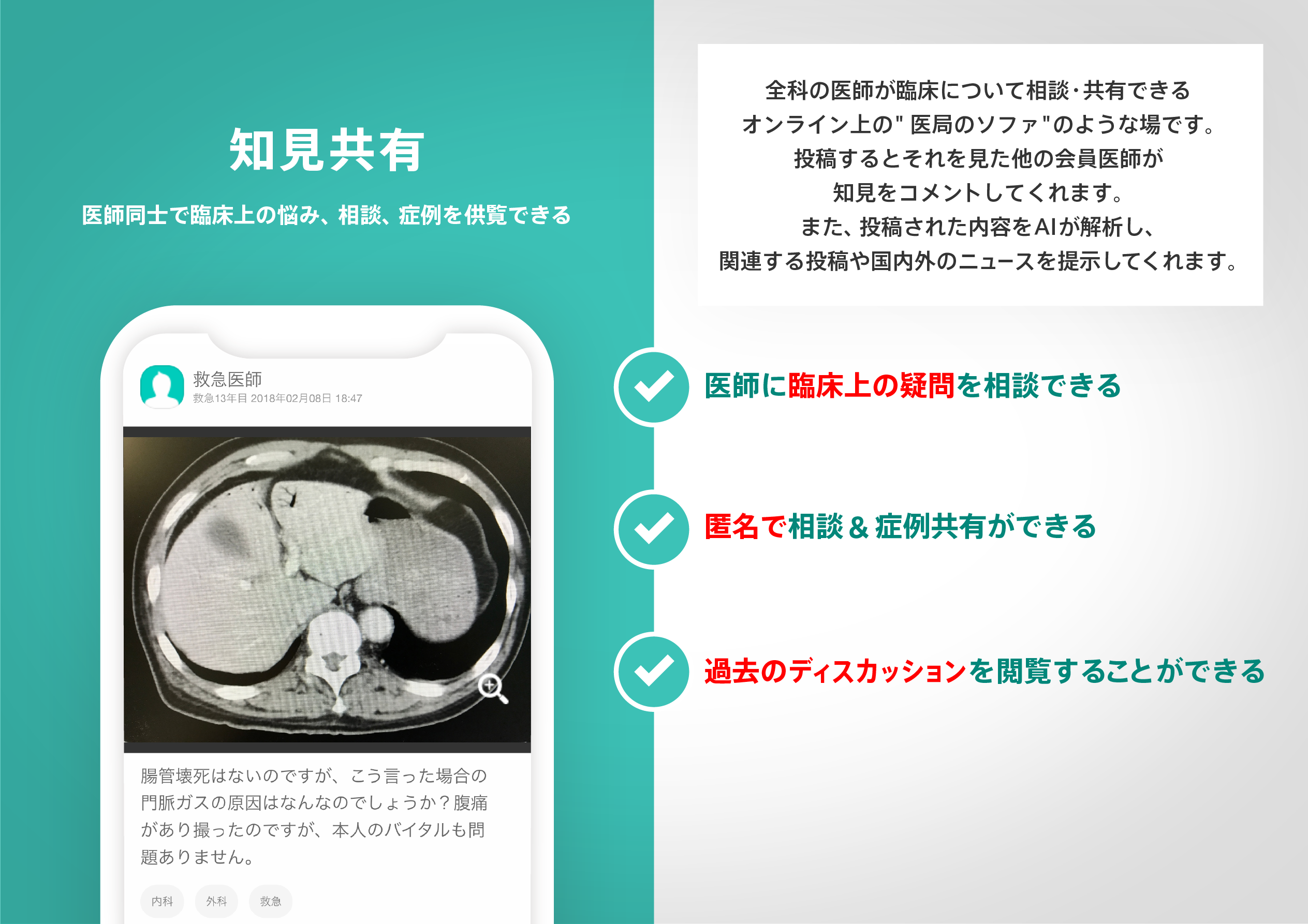
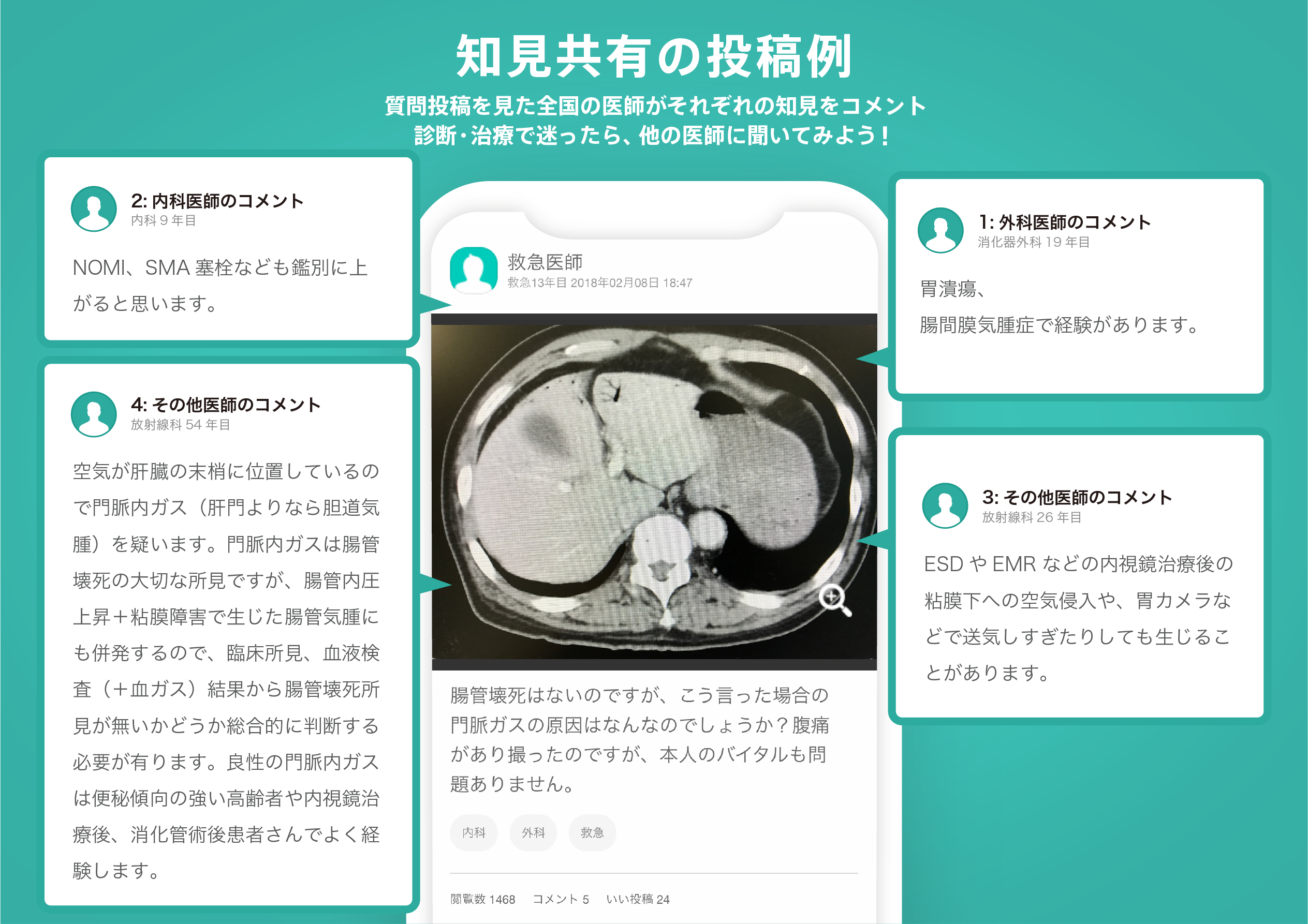
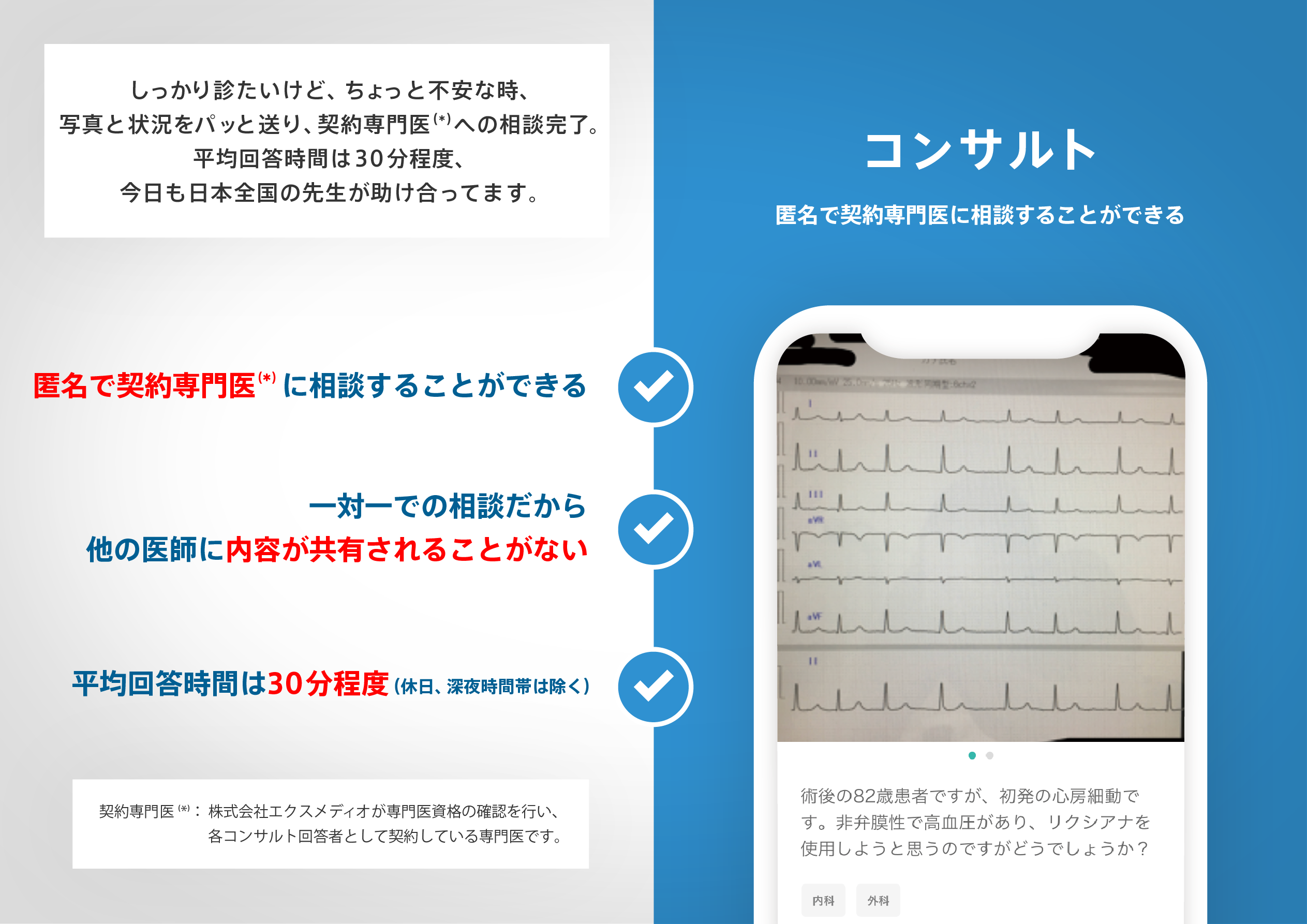
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。