著名医師による解説が無料で読めます
すると翻訳の精度が向上します
tRNA が翻訳中にリボソーム A、P、および E 部位を迅速かつ正確に通過するメカニズムを解明することは、依然としてタンパク質合成の研究における主要な目標です。今回我々は、翻訳中のtRNAの動きの制御に関与する大きなリボソームサブユニットの構造要素であるL1ストークのリアルタイムダイナミクスを報告する。転座前リボソーム複合体内では、L1 ストークは開いた立体構造と閉じた立体構造の間の動的平衡状態で存在します。伸長因子 G (EF-G) の結合は、少なくとも 2 つの異なる速度論的機構の 1 つを介してこの平衡を閉じた立体配座にシフトさせます。P サイト tRNA の正体が、取られる速度論的経路を決定します。転座後複合体内での L1 ストークの動態は、E サイト tRNA の存在と正体に依存します。まとめると、我々のデータは、EF-G と L1 ストークがアロステリックに連携して P 部位から E 部位への tRNA 移行を指示することを実証し、E 部位 tRNA の放出モデルを示唆しています。
tRNA が翻訳中にリボソーム A、P、および E 部位を迅速かつ正確に通過するメカニズムを解明することは、依然としてタンパク質合成の研究における主要な目標です。今回我々は、翻訳中のtRNAの動きの制御に関与する大きなリボソームサブユニットの構造要素であるL1ストークのリアルタイムダイナミクスを報告する。転座前リボソーム複合体内では、L1 ストークは開いた立体構造と閉じた立体構造の間の動的平衡状態で存在します。伸長因子 G (EF-G) の結合は、少なくとも 2 つの異なる速度論的機構の 1 つを介してこの平衡を閉じた立体配座にシフトさせます。P サイト tRNA の正体が、取られる速度論的経路を決定します。転座後複合体内での L1 ストークの動態は、E サイト tRNA の存在と正体に依存します。まとめると、我々のデータは、EF-G と L1 ストークがアロステリックに連携して P 部位から E 部位への tRNA 移行を指示することを実証し、E 部位 tRNA の放出モデルを示唆しています。
Determining the mechanism by which tRNAs rapidly and precisely transit through the ribosomal A, P, and E sites during translation remains a major goal in the study of protein synthesis. Here, we report the real-time dynamics of the L1 stalk, a structural element of the large ribosomal subunit that is implicated in directing tRNA movements during translation. Within pretranslocation ribosomal complexes, the L1 stalk exists in a dynamic equilibrium between open and closed conformations. Binding of elongation factor G (EF-G) shifts this equilibrium toward the closed conformation through one of at least two distinct kinetic mechanisms, where the identity of the P-site tRNA dictates the kinetic route that is taken. Within posttranslocation complexes, L1 stalk dynamics are dependent on the presence and identity of the E-site tRNA. Collectively, our data demonstrate that EF-G and the L1 stalk allosterically collaborate to direct tRNA translocation from the P to the E sites, and suggest a model for the release of E-site tRNA.
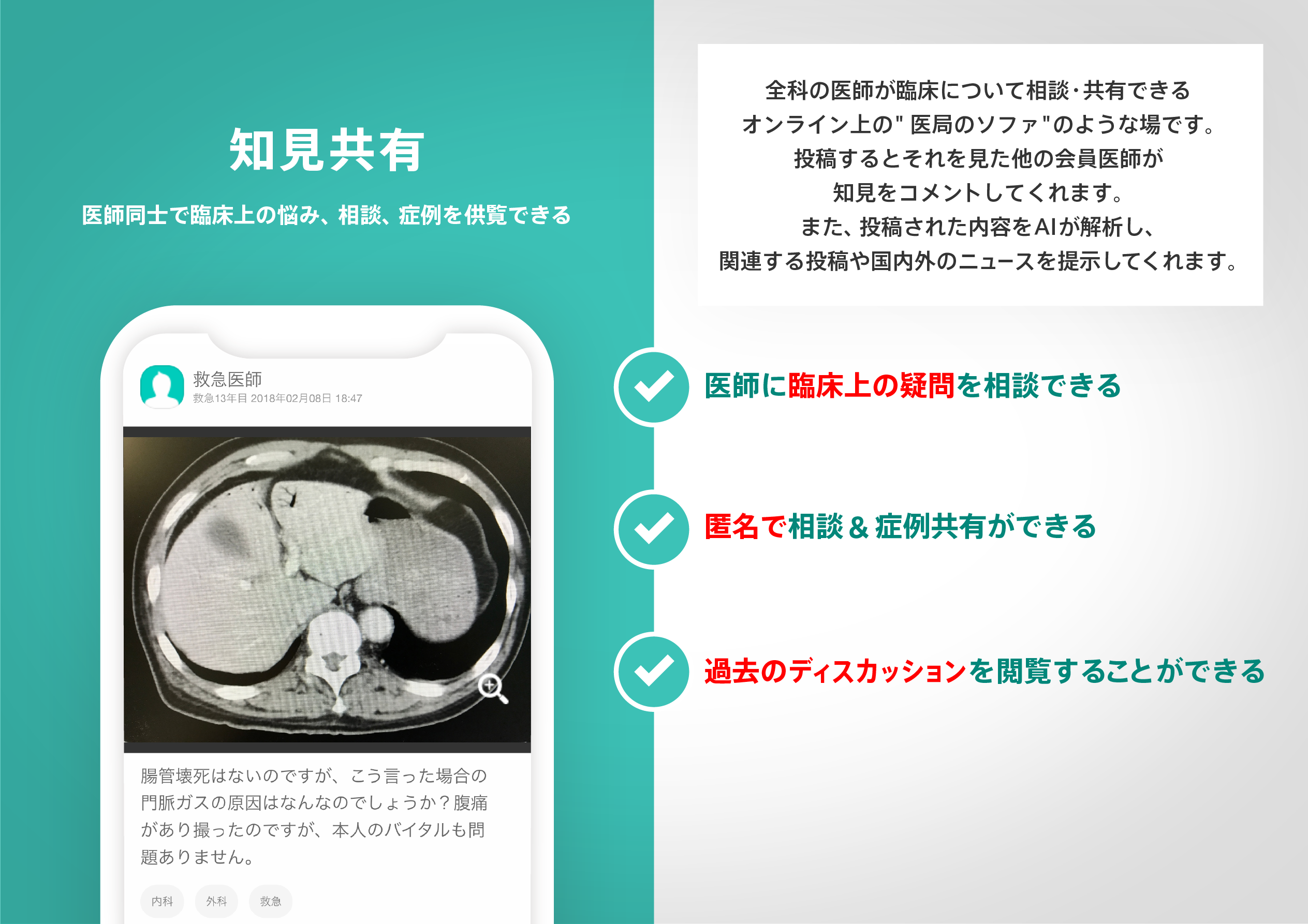
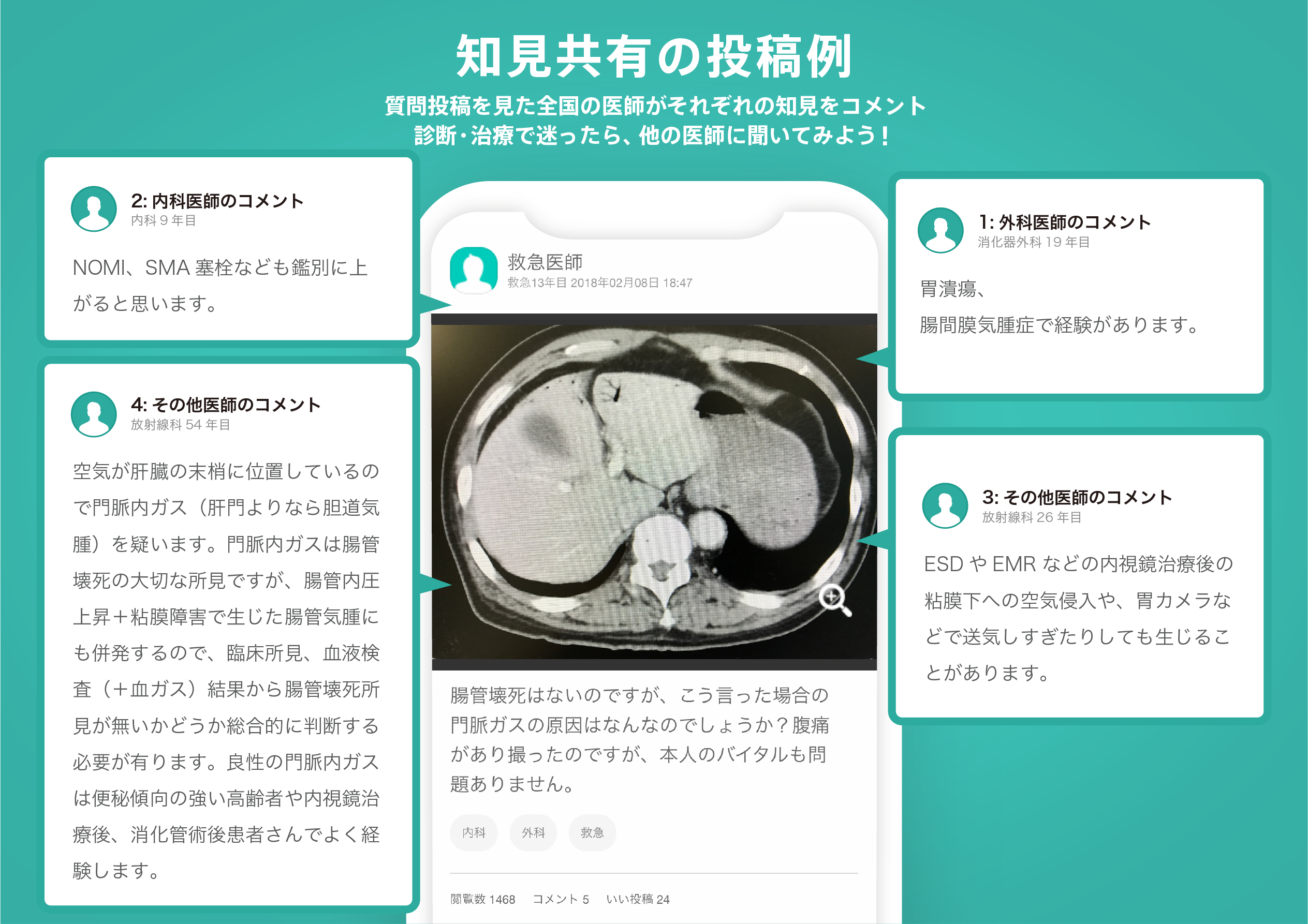
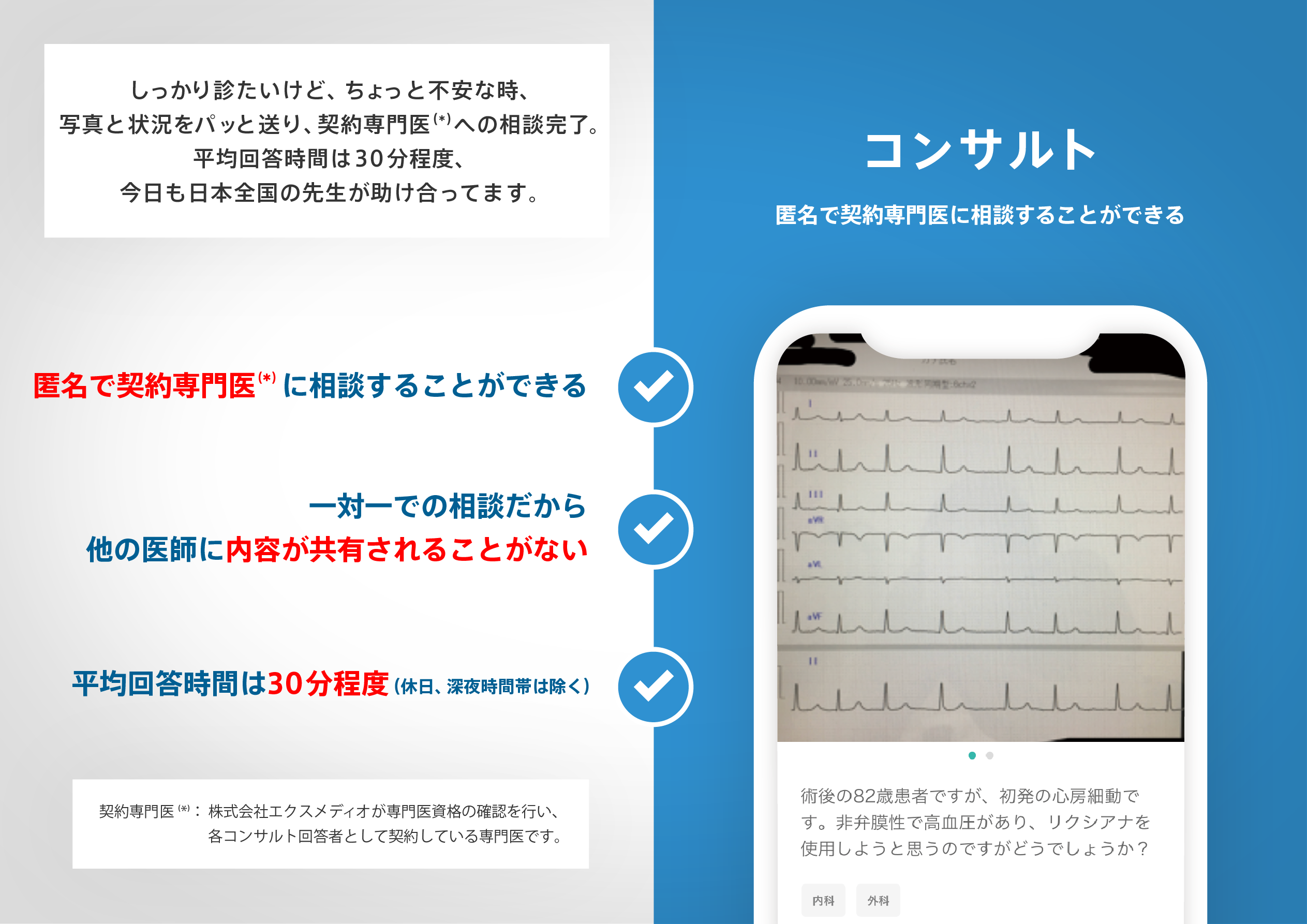
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。