著名医師による解説が無料で読めます
すると翻訳の精度が向上します
本質的に無秩序なタンパク質のファミリーのよく知られているメンバーであるエストロゲン受容体アルファのN末端トランス活性化ドメイン(NTD)は、受容体のトランス活性化機能を媒介します。ただし、NTDの構造機能関係の正確な分子分離はとらえどころのないままです。ここでは、NTDが、化学変性で構造的拡張を受ける、ほとんど障害のある予期せぬコンパクトな立体構造を採用していることを示します。小角X線散乱、ヒドロキシルラジカルタンパク質フットプリント、および計算モデリングを組み合わせることにより、NTDのアンサンブル構造を導き出し、そのアンサンブルコンタクトマップを決定し、残留物I33とS118の間のメタスト可能な長距離接触を明らかにします。既知のリン酸化部位であるS118での突然変異が、立体構造の変化を促進し、コアクチベーターの結合を増加させることを示しています。さらに、I33近くの変異がS118で19F化学シフトを変化させ、構造障害のアンサンブルで提案されたI33-S118接触を確認するというフッ素-19(19F)核磁気共鳴を介して実証します。これらの発見は、特定の接触の加盟性が無秩序なタンパク質の重要な機能をどのように媒介するかについての理解を広げています。
本質的に無秩序なタンパク質のファミリーのよく知られているメンバーであるエストロゲン受容体アルファのN末端トランス活性化ドメイン(NTD)は、受容体のトランス活性化機能を媒介します。ただし、NTDの構造機能関係の正確な分子分離はとらえどころのないままです。ここでは、NTDが、化学変性で構造的拡張を受ける、ほとんど障害のある予期せぬコンパクトな立体構造を採用していることを示します。小角X線散乱、ヒドロキシルラジカルタンパク質フットプリント、および計算モデリングを組み合わせることにより、NTDのアンサンブル構造を導き出し、そのアンサンブルコンタクトマップを決定し、残留物I33とS118の間のメタスト可能な長距離接触を明らかにします。既知のリン酸化部位であるS118での突然変異が、立体構造の変化を促進し、コアクチベーターの結合を増加させることを示しています。さらに、I33近くの変異がS118で19F化学シフトを変化させ、構造障害のアンサンブルで提案されたI33-S118接触を確認するというフッ素-19(19F)核磁気共鳴を介して実証します。これらの発見は、特定の接触の加盟性が無秩序なタンパク質の重要な機能をどのように媒介するかについての理解を広げています。
The N-terminal transactivation domain (NTD) of estrogen receptor alpha, a well-known member of the family of intrinsically disordered proteins, mediates the receptor's transactivation function. However, an accurate molecular dissection of NTD's structure-function relationships remains elusive. Here, we show that the NTD adopts a mostly disordered, unexpectedly compact conformation that undergoes structural expansion on chemical denaturation. By combining small-angle X-ray scattering, hydroxyl radical protein footprinting, and computational modeling, we derive the ensemble-structures of the NTD and determine its ensemble-contact map revealing metastable long-range contacts, e.g., between residues I33 and S118. We show that mutation at S118, a known phosphorylation site, promotes conformational changes and increases coactivator binding. We further demonstrate via fluorine-19 (19F) nuclear magnetic resonance that mutations near I33 alter 19F chemical shifts at S118, confirming the proposed I33-S118 contact in the ensemble of structural disorder. These findings extend our understanding of how specific contact metastability mediates critical functions of disordered proteins.
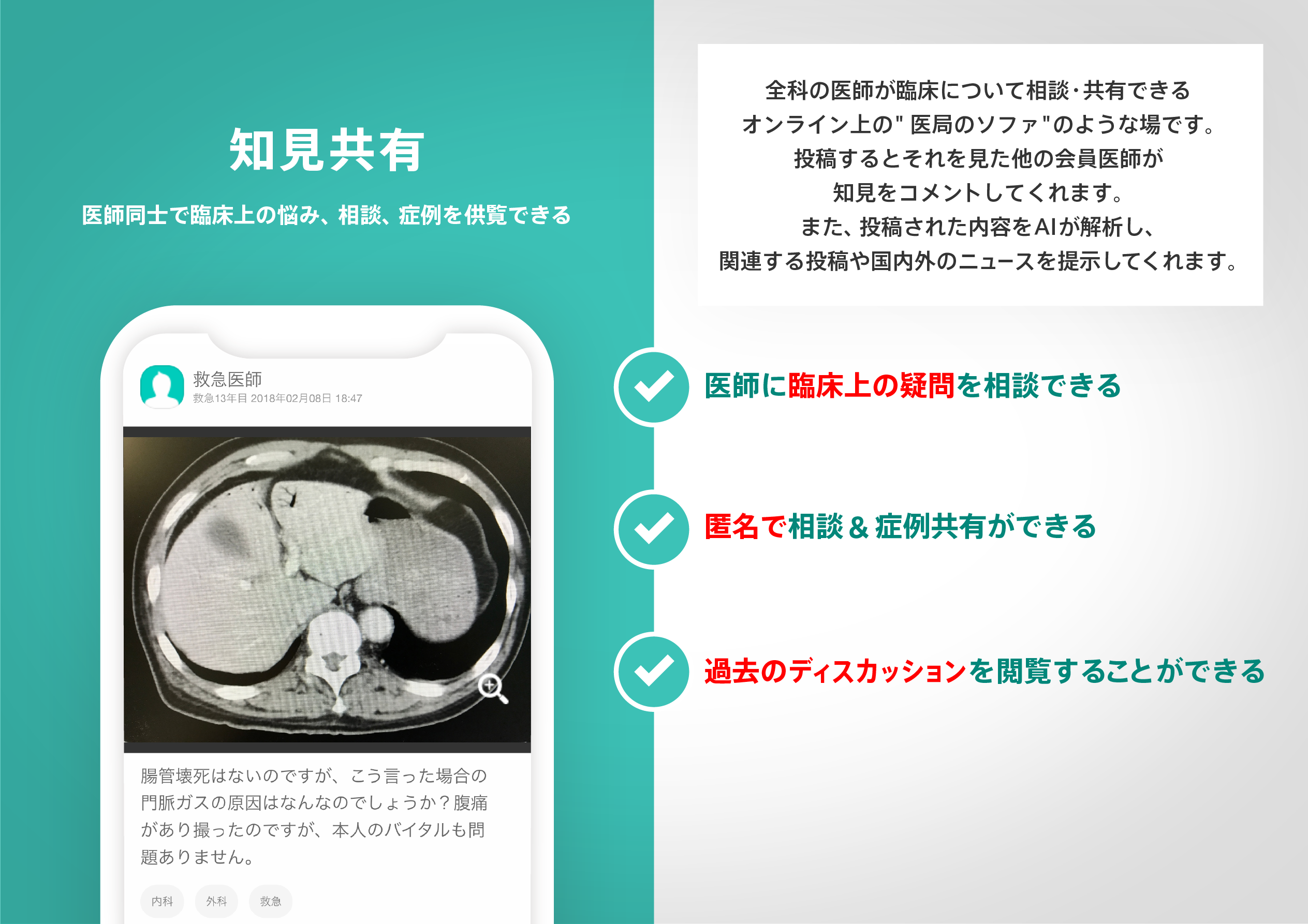
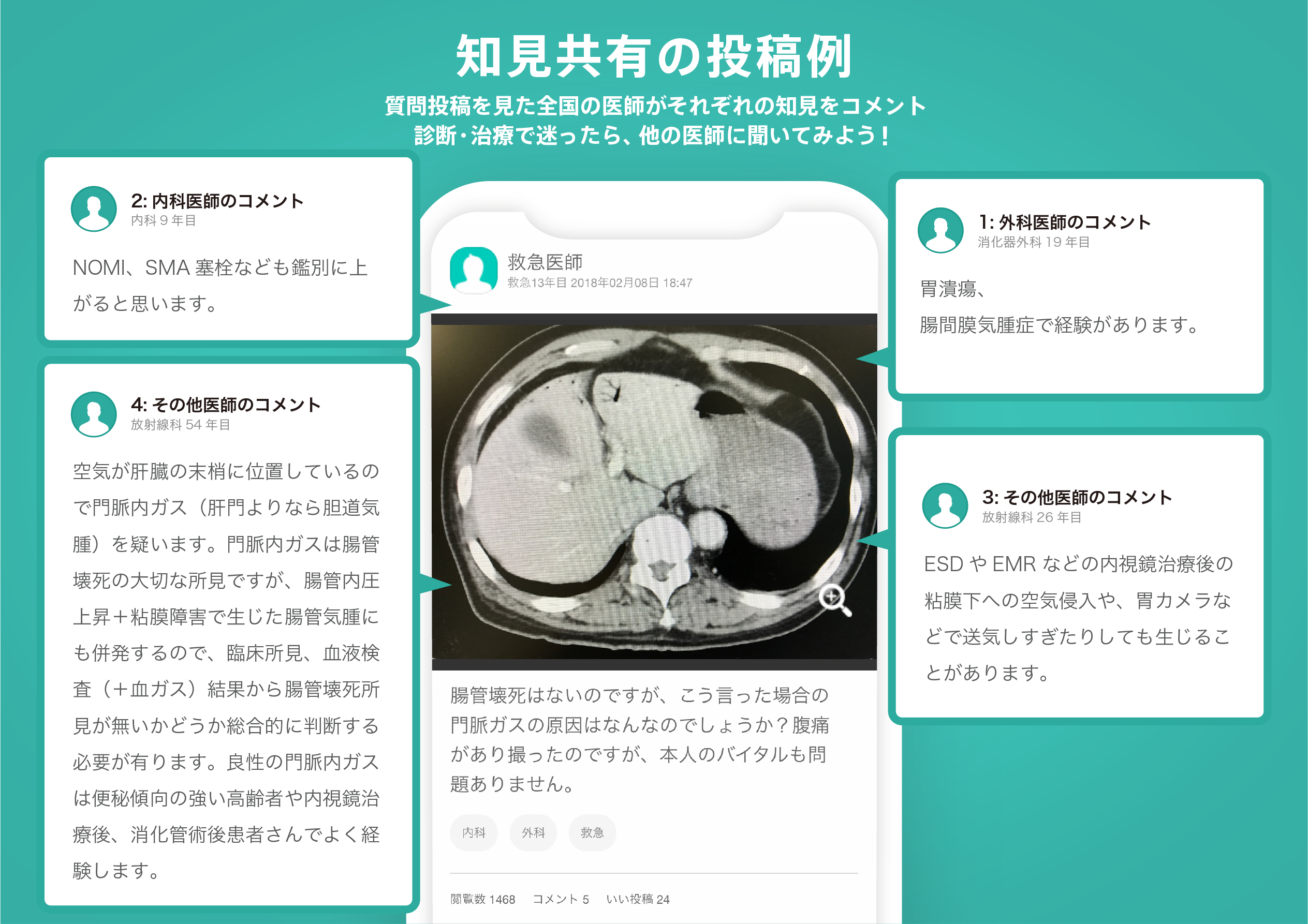
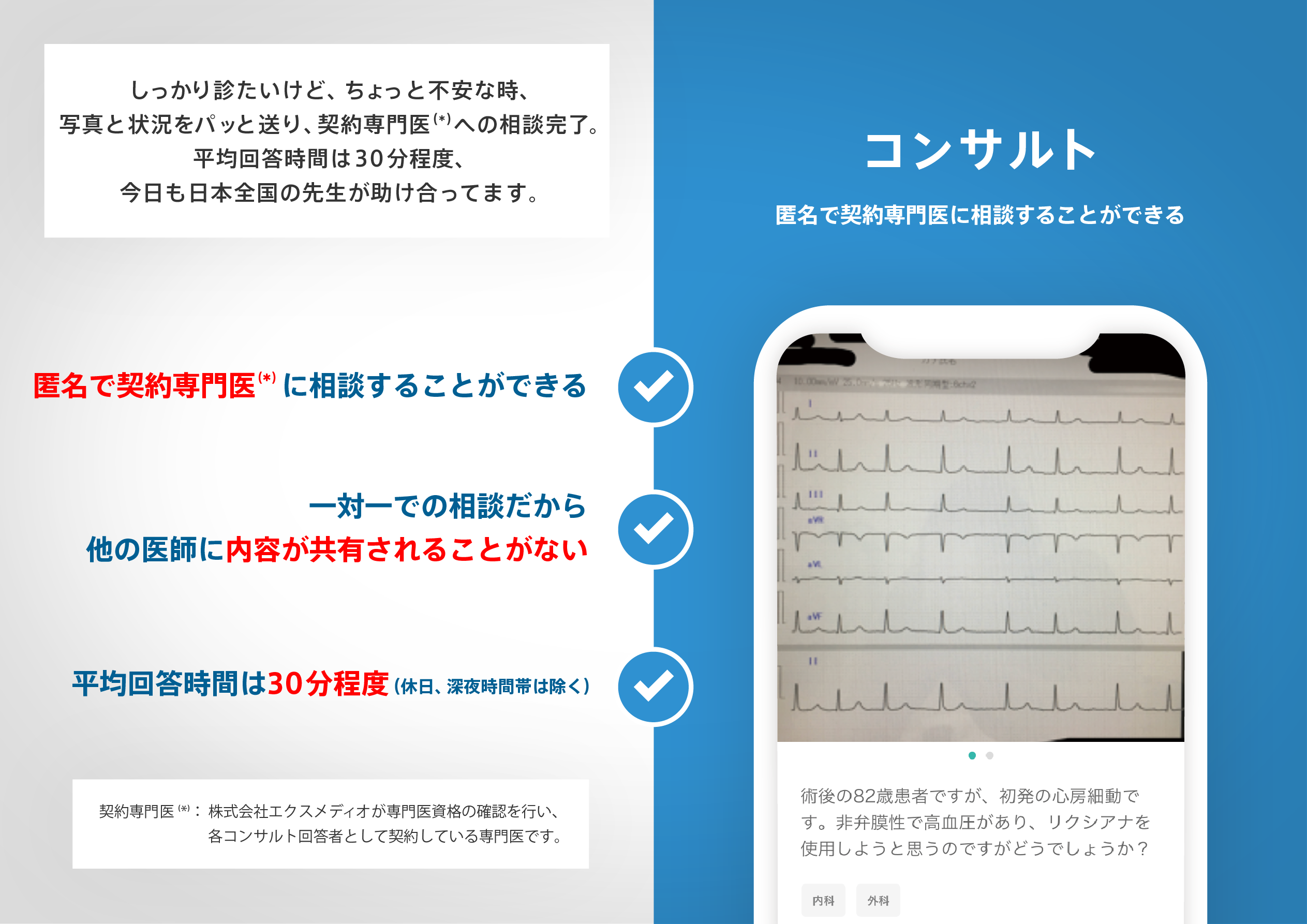
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。