著名医師による解説が無料で読めます
すると翻訳の精度が向上します
このタンパク質の複数のアスパラギン結合複合体(ユニットB)炭水化物単位を表すヒトチログロブリングリコペプチドは、かなりの量の硫酸塩を含むことがわかりました(0.5〜2.5 mol/molの乏糖);この置換基は、主に、シアル酸と同等の量で発生する新規キャッピング基を表す末端ベータ結合GAL-3-SO4残基の形で発生することが示されました。ヒドラジン/亜硝酸断片化とNab3H4による放射標識により、すべてのヒトユニットB DEAE分解グリコペプチド画分は、GAL-3-SO4ベータ1 ---- 4-アニドロマンニトールとして特徴付けられた酸性二糖糖を生成しました。デシアリル化、脱硫、ベータガラクトシダーゼ処理によって修飾されたグリコペプチドに関する研究は、複雑な炭水化物単位の大部分(約70%)に硫酸塩基が含まれており、GAL-3-SO4およびシアル酸残基が同じで末端位置で共存できることを示しています。N結合オリゴ糖。GAL-3-SO4に加えて、最も酸性のユニットBバリアントは、ヒドラジン/亜硝酸処理およびNAB3H4処理後にGALベータ1 --- 4-Anhydromannitol-6-SO4として回収されたGLCNAC-6-SO4を含むことがわかりました。削減。固定化されたコンカナバリンAのクロマトグラフィーに基づいて、GAL-3-SO4基は二分年に発生し、より高度に分岐した炭水化物単位で発生することが判断されました。N結合炭水化物ユニットとは対照的に、ヒトチログロブリンの前述のO結合グリコサミノグリカン鎖は、GLCAベータ1 ---- 3-アンヒドロタリトール-6-SO4を生成しました。クロンドロイチン6-硫酸塩様ポリマー。子牛のチログロブリンの複雑なオリゴ糖における硫酸塩の分布は、ヒトタンパク質のそれとはまったく異なっていました。硫酸塩は、ほとんどのグリコペプチドでは検出できず、等量のGal-3-SO4およびGLCNAC-6-SO4を含む単一の多鉄鉱型グリコペプチド画分(1.6 molの硫酸塩/硫酸モル/モルのオリゴ糖)に隔離されました。ヒトと子牛のチログロブリンの間のガラクトース硫酸化の違いは、アルファ-d-galキャッピング基によるいくつかのガラクトース残基の後者のタンパク質の置換に関連している可能性があります。
このタンパク質の複数のアスパラギン結合複合体(ユニットB)炭水化物単位を表すヒトチログロブリングリコペプチドは、かなりの量の硫酸塩を含むことがわかりました(0.5〜2.5 mol/molの乏糖);この置換基は、主に、シアル酸と同等の量で発生する新規キャッピング基を表す末端ベータ結合GAL-3-SO4残基の形で発生することが示されました。ヒドラジン/亜硝酸断片化とNab3H4による放射標識により、すべてのヒトユニットB DEAE分解グリコペプチド画分は、GAL-3-SO4ベータ1 ---- 4-アニドロマンニトールとして特徴付けられた酸性二糖糖を生成しました。デシアリル化、脱硫、ベータガラクトシダーゼ処理によって修飾されたグリコペプチドに関する研究は、複雑な炭水化物単位の大部分(約70%)に硫酸塩基が含まれており、GAL-3-SO4およびシアル酸残基が同じで末端位置で共存できることを示しています。N結合オリゴ糖。GAL-3-SO4に加えて、最も酸性のユニットBバリアントは、ヒドラジン/亜硝酸処理およびNAB3H4処理後にGALベータ1 --- 4-Anhydromannitol-6-SO4として回収されたGLCNAC-6-SO4を含むことがわかりました。削減。固定化されたコンカナバリンAのクロマトグラフィーに基づいて、GAL-3-SO4基は二分年に発生し、より高度に分岐した炭水化物単位で発生することが判断されました。N結合炭水化物ユニットとは対照的に、ヒトチログロブリンの前述のO結合グリコサミノグリカン鎖は、GLCAベータ1 ---- 3-アンヒドロタリトール-6-SO4を生成しました。クロンドロイチン6-硫酸塩様ポリマー。子牛のチログロブリンの複雑なオリゴ糖における硫酸塩の分布は、ヒトタンパク質のそれとはまったく異なっていました。硫酸塩は、ほとんどのグリコペプチドでは検出できず、等量のGal-3-SO4およびGLCNAC-6-SO4を含む単一の多鉄鉱型グリコペプチド画分(1.6 molの硫酸塩/硫酸モル/モルのオリゴ糖)に隔離されました。ヒトと子牛のチログロブリンの間のガラクトース硫酸化の違いは、アルファ-d-galキャッピング基によるいくつかのガラクトース残基の後者のタンパク質の置換に関連している可能性があります。
Human thyroglobulin glycopeptides representing the multiple asparagine-linked complex (unit B) carbohydrate units of this protein were found to contain substantial amounts of sulfate (ranging from 0.5 to 2.5 mol/mol of oligosaccharide); this substituent was shown to occur primarily in the form of terminal beta-linked Gal-3-SO4 residues which represent novel capping groups occurring alternatively to sialic acid and in comparable amounts. Upon hydrazine/nitrous acid fragmentation and radiolabeling with NaB3H4, all human unit B DEAE-resolved glycopeptide fractions yielded an acidic disaccharide which was characterized as Gal-3-SO4 beta 1----4-anhydromannitol. Studies on glycopeptides modified by desialylation, desulfation, and beta-galactosidase treatment indicated that the majority (approximately 70%) of the complex carbohydrate units contain sulfate groups and that Gal-3-SO4 and sialic acid residues can coexist in terminal positions on the same N-linked oligosaccharide. In addition to Gal-3-SO4, the most acidic unit B variants were found to contain GlcNAc-6-SO4 which was recovered as Gal beta 1----4-anhydromannitol-6-SO4 after hydrazine/nitrous acid treatment and NaB3H4 reduction. On the basis of chromatography on immobilized concanavalin A, it was determined that whereas the Gal-3-SO4 groups occur on biantennary as well as more highly branched carbohydrate units, GlcNAc-6-SO4 is exclusively present in the latter oligosaccharides. In contrast to the N-linked carbohydrate units, the previously described O-linked glycosaminoglycan chain of human thyroglobulin yielded GlcA beta 1----3-anhydrotalitol-6-SO4 upon hydrazine/nitrous acid/NaB3H4 treatment, indicating that it is a chrondroitin 6-sulfate-like polymer. The distribution of sulfate in the complex oligosaccharides of calf thyroglobulin was quite different from that in the human protein; sulfate was not detectable in most of the glycopeptides and was sequestered in a single multibranched complex-type glycopeptide fraction (1.6 mol of sulfate/mol of oligosaccharide) which contained about equal amounts of Gal-3-SO4 and GlcNAc-6-SO4. The difference in galactose sulfation between human and calf thyroglobulins may be related to the substitution in the latter protein of some of the galactose residues by alpha-D-Gal capping groups.
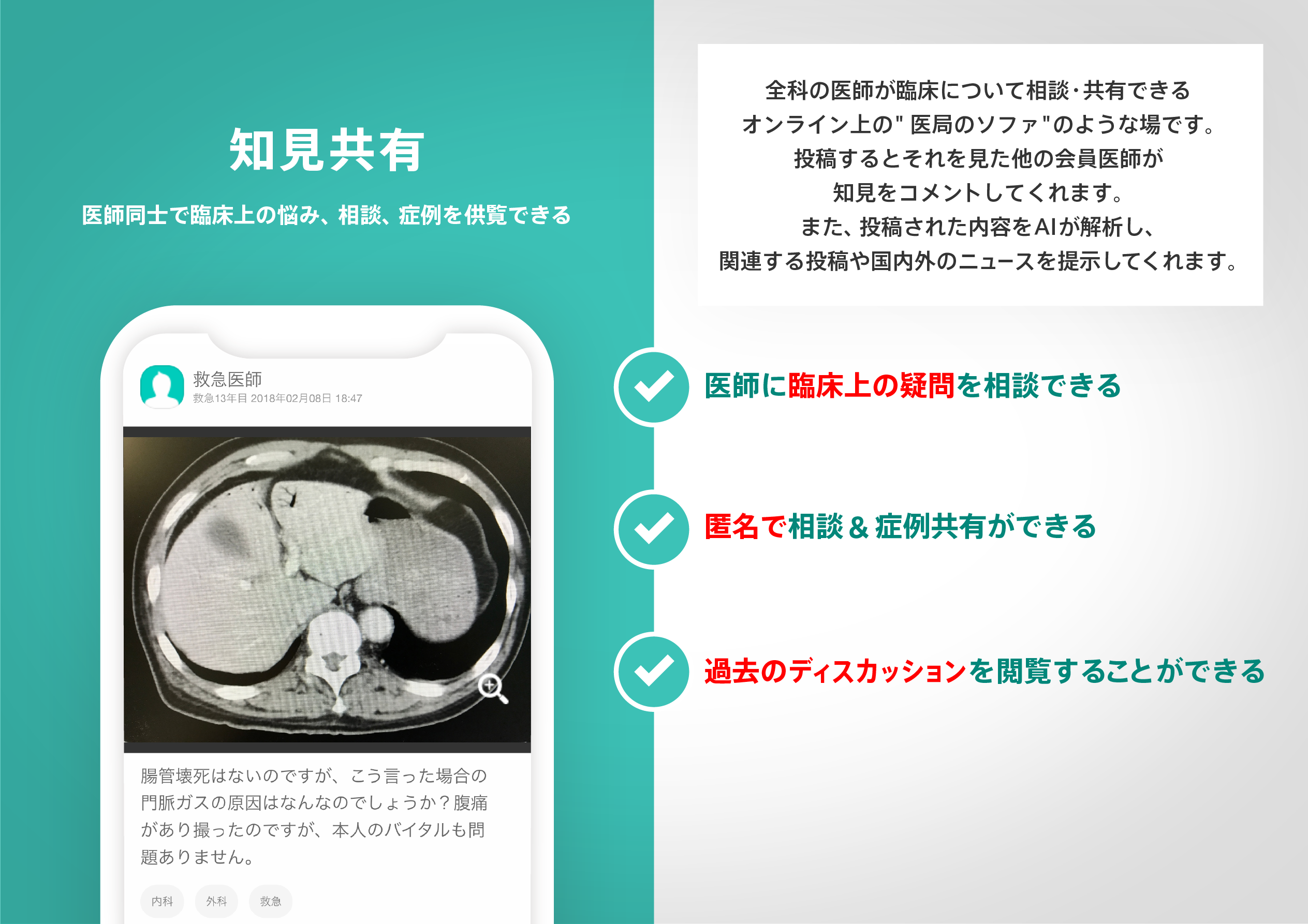
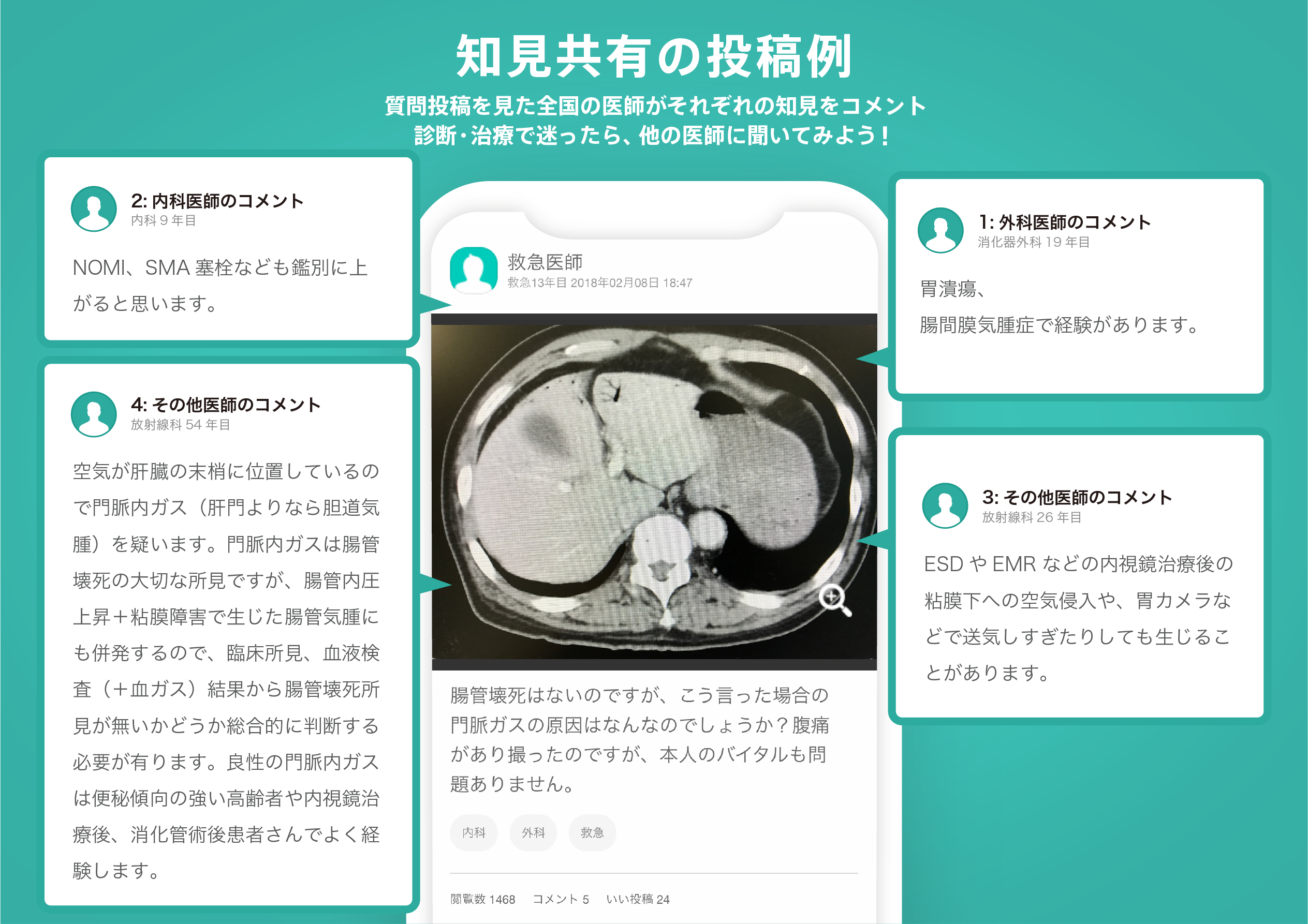
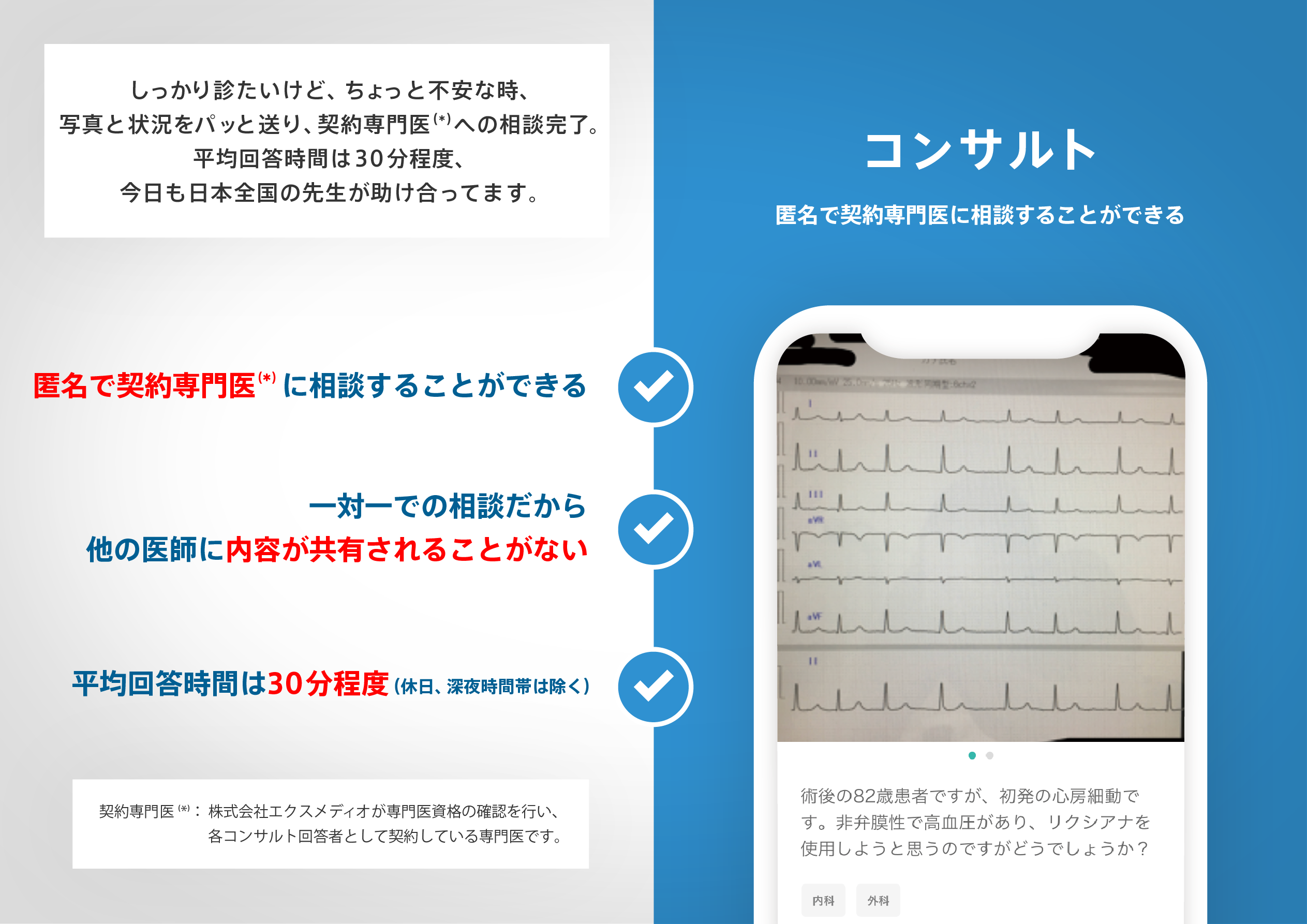
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。