著名医師による解説が無料で読めます
すると翻訳の精度が向上します
ミトファジーは、ミトコンドリアの品質管理を調節する重要なプロセスです。いくつかのメカニズムがミトファジーを調節するために提案されていますが、これらは主に不死化細胞株で安定して発現した非ネイティブタンパク質を使用して研究されています。骨格筋では、マイトファジーとその分子メカニズムには、より徹底的な調査が必要です。マイトファジーを直接測定するために、安定した骨格筋C2C12細胞株を生成し、ミトファジーレポーターコンストラクト(MCHERRY-GREEN蛍光タンパク質-MTFIS1101-152)を発現しました。ここでは、991によるカルボニルシアン化物M-クロロフェニルヒドラゾン(CCCP)処理とアデノシン一リン酸タンパク質キナーゼ(AMPK)活性化の両方が、MFFのリン酸化を介してミトコンドリア核分裂を促進し、乳頭脱脂を〜20%誘導することの両方を報告します。991ではなくCCCP処理時に、ユビキチンリン酸化、PTEN誘発キナーゼ1(PINK1)活性の読み取り、およびCDGSH鉄硫黄ドメイン1(CISD1)に対するパーキンE3リガーゼ活性が増加しました。Pink1-Parkinシグナル伝達経路はCCCP治療に応じて活性がありますが、ミトコンドリアタンパク質含有量のマーカーに変化は見られませんでした。興味深いことに、我々のデータは、CCCPと991の両方の治療後にタンク結合キナーゼ1(TBK1)のリン酸化が増加することを示しており、TBK1の活性化はPink1とパーキンの両方に依存しないことを示唆しています。最後に、非筋肉細胞株で、TBK1リン酸化がPINK1の非存在下で発生し、AMPK依存性シグナル伝達によって調節されていることを確認しました。したがって、AMPKの活性化は、Pink1-Parkinの独立方法でミトコンドリア核分裂(MFFリン酸化を介して)およびオートファゴソームの飲み込み(TBK1活性化を介して)を促進することにより、ミトファジーを促進します。
ミトファジーは、ミトコンドリアの品質管理を調節する重要なプロセスです。いくつかのメカニズムがミトファジーを調節するために提案されていますが、これらは主に不死化細胞株で安定して発現した非ネイティブタンパク質を使用して研究されています。骨格筋では、マイトファジーとその分子メカニズムには、より徹底的な調査が必要です。マイトファジーを直接測定するために、安定した骨格筋C2C12細胞株を生成し、ミトファジーレポーターコンストラクト(MCHERRY-GREEN蛍光タンパク質-MTFIS1101-152)を発現しました。ここでは、991によるカルボニルシアン化物M-クロロフェニルヒドラゾン(CCCP)処理とアデノシン一リン酸タンパク質キナーゼ(AMPK)活性化の両方が、MFFのリン酸化を介してミトコンドリア核分裂を促進し、乳頭脱脂を〜20%誘導することの両方を報告します。991ではなくCCCP処理時に、ユビキチンリン酸化、PTEN誘発キナーゼ1(PINK1)活性の読み取り、およびCDGSH鉄硫黄ドメイン1(CISD1)に対するパーキンE3リガーゼ活性が増加しました。Pink1-Parkinシグナル伝達経路はCCCP治療に応じて活性がありますが、ミトコンドリアタンパク質含有量のマーカーに変化は見られませんでした。興味深いことに、我々のデータは、CCCPと991の両方の治療後にタンク結合キナーゼ1(TBK1)のリン酸化が増加することを示しており、TBK1の活性化はPink1とパーキンの両方に依存しないことを示唆しています。最後に、非筋肉細胞株で、TBK1リン酸化がPINK1の非存在下で発生し、AMPK依存性シグナル伝達によって調節されていることを確認しました。したがって、AMPKの活性化は、Pink1-Parkinの独立方法でミトコンドリア核分裂(MFFリン酸化を介して)およびオートファゴソームの飲み込み(TBK1活性化を介して)を促進することにより、ミトファジーを促進します。
Mitophagy is a key process regulating mitochondrial quality control. Several mechanisms have been proposed to regulate mitophagy, but these have mostly been studied using stably expressed non-native proteins in immortalized cell lines. In skeletal muscle, mitophagy and its molecular mechanisms require more thorough investigation. To measure mitophagy directly, we generated a stable skeletal muscle C2C12 cell line, expressing a mitophagy reporter construct (mCherry-green fluorescence protein-mtFIS1101-152 ). Here, we report that both carbonyl cyanide m-chlorophenyl hydrazone (CCCP) treatment and adenosine monophosphate activated protein kinase (AMPK) activation by 991 promote mitochondrial fission via phosphorylation of MFF and induce mitophagy by ~20%. Upon CCCP treatment, but not 991, ubiquitin phosphorylation, a read-out of PTEN-induced kinase 1 (PINK1) activity, and Parkin E3 ligase activity toward CDGSH iron sulfur domain 1 (CISD1) were increased. Although the PINK1-Parkin signaling pathway is active in response to CCCP treatment, we observed no change in markers of mitochondrial protein content. Interestingly, our data shows that TANK-binding kinase 1 (TBK1) phosphorylation is increased after both CCCP and 991 treatments, suggesting TBK1 activation to be independent of both PINK1 and Parkin. Finally, we confirmed in non-muscle cell lines that TBK1 phosphorylation occurs in the absence of PINK1 and is regulated by AMPK-dependent signaling. Thus, AMPK activation promotes mitophagy by enhancing mitochondrial fission (via MFF phosphorylation) and autophagosomal engulfment (via TBK1 activation) in a PINK1-Parkin independent manner.
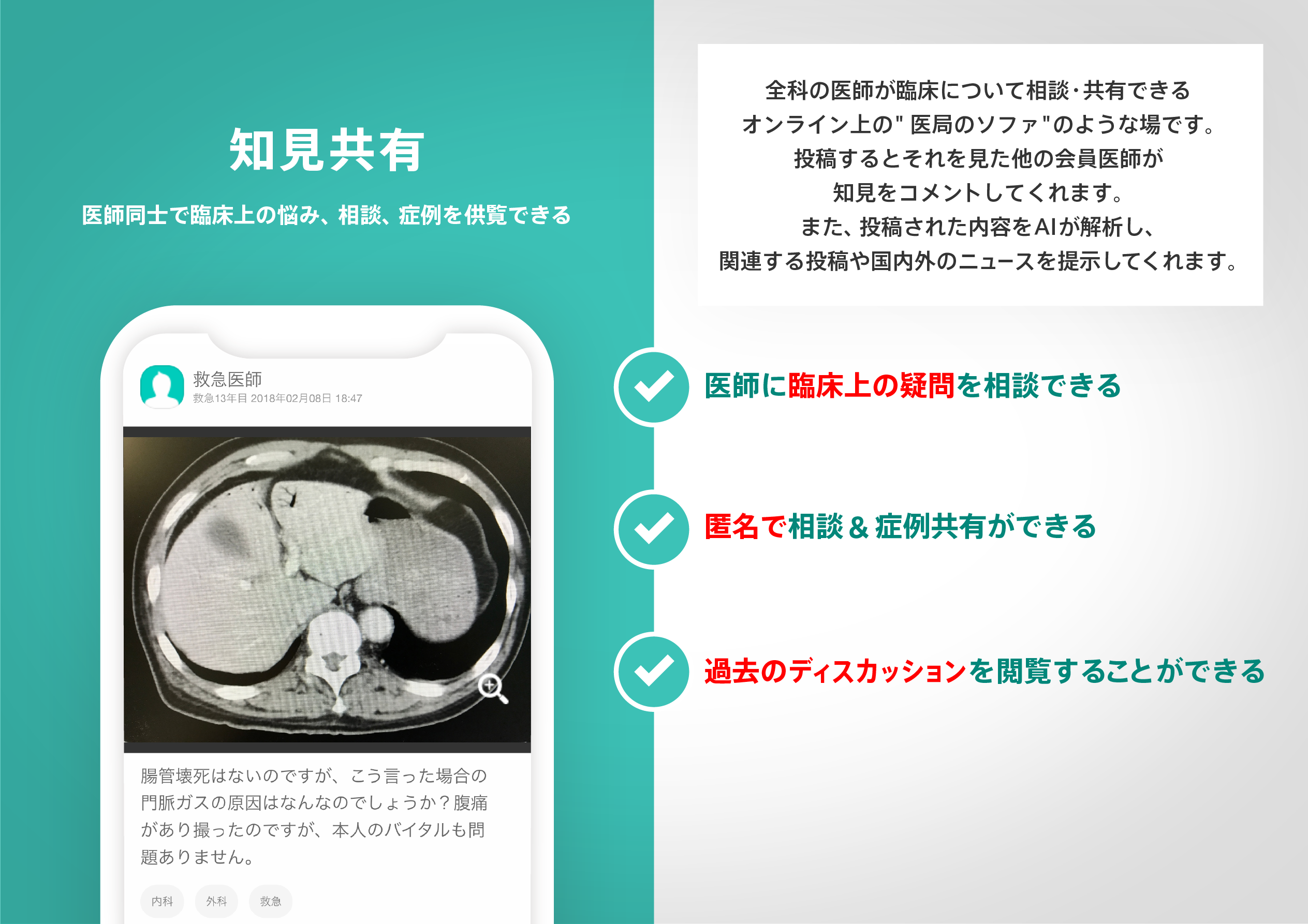
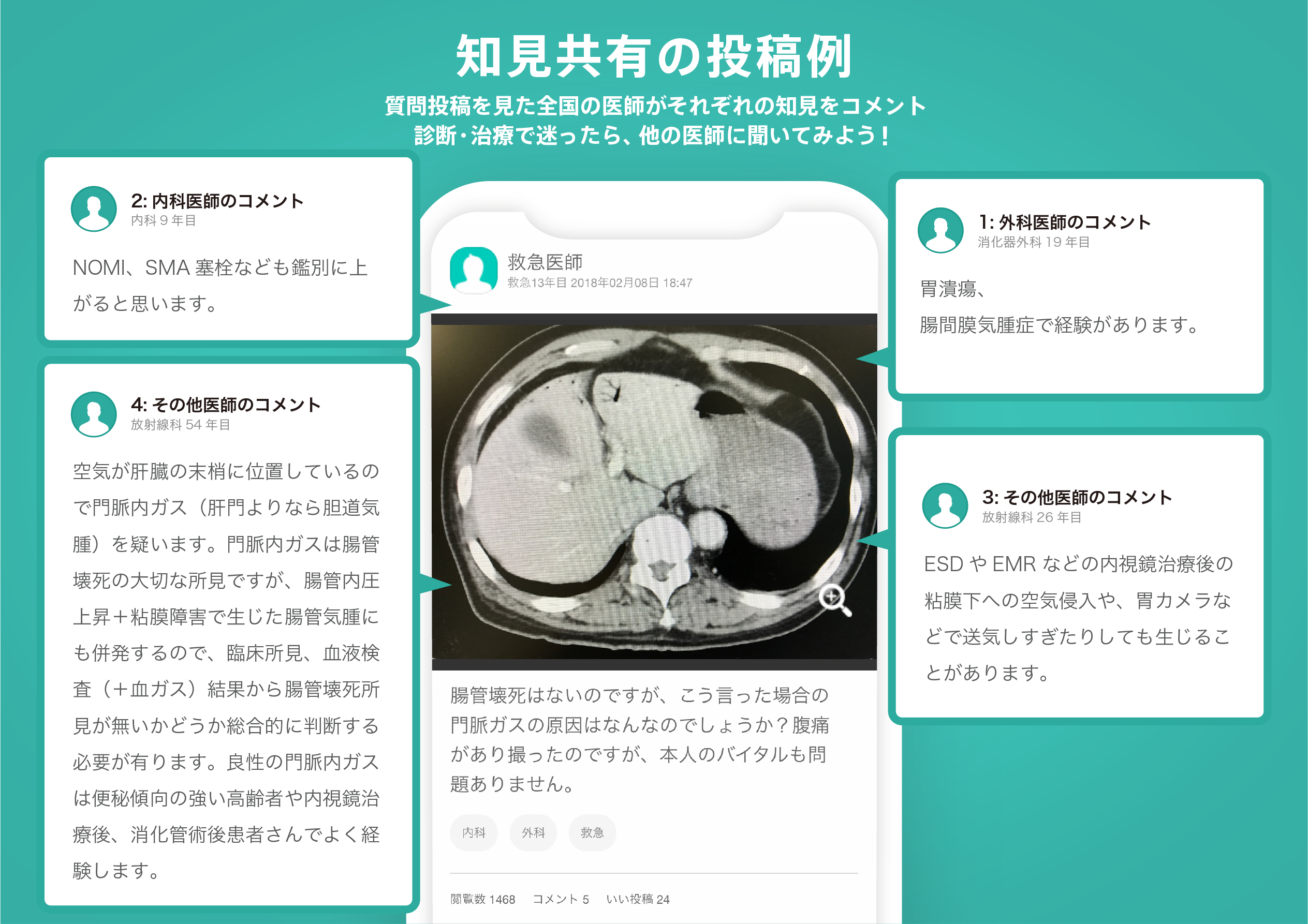
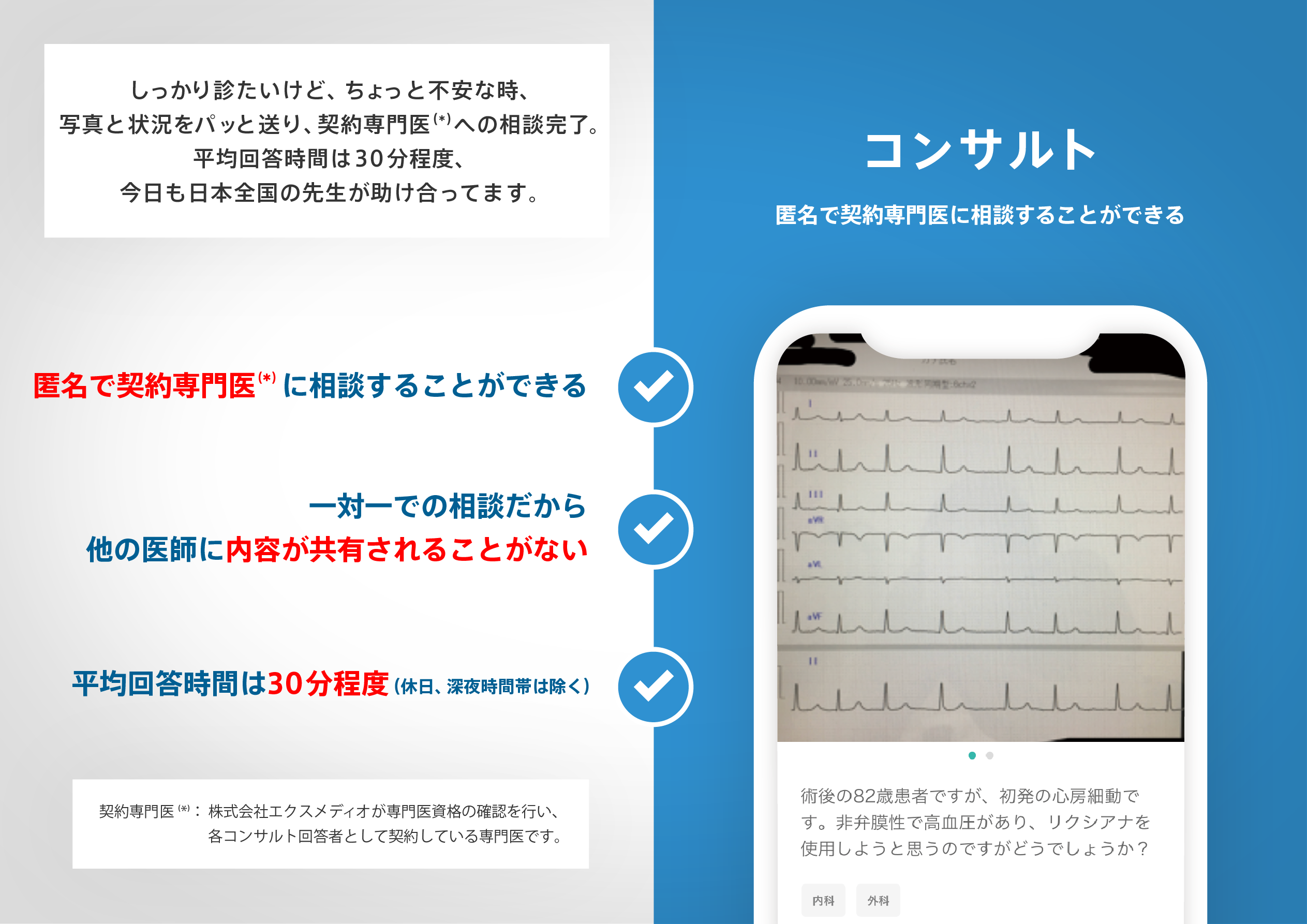
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。