著名医師による解説が無料で読めます
すると翻訳の精度が向上します
3つの腎臓微生物膜外酵素の膜固定モードが調べられました。細菌ホスファチジルイノシトール特異的ホスホリパーゼC(PI-PLC)による腎膜からのアミノペプチダーゼP(EC 3.4.11.9)の放出と、このエクトエンザイムの界面活性剤溶解のパターンは、協で付着したグリコシル - ホスファトリン酸性症を介して膜に固定されていることを和らげます。部分。トリトンX-114の位相分離によって推定されるように、オクチルグルコシドはアミノペプチダーゼPの両親媒性型を可溶化しましたが、PI-PLCリリースされた型は親水性特性を示しました。対照的に、2つの微小型カルボキシペプチダーゼの洗剤可溶化のパターンと、細菌PI-PLCによる膜からの放出に対する耐性は、これら2つのエクトエンザイムがホスファチジルイノシトールを介して固定されていないことを示唆しています。
3つの腎臓微生物膜外酵素の膜固定モードが調べられました。細菌ホスファチジルイノシトール特異的ホスホリパーゼC(PI-PLC)による腎膜からのアミノペプチダーゼP(EC 3.4.11.9)の放出と、このエクトエンザイムの界面活性剤溶解のパターンは、協で付着したグリコシル - ホスファトリン酸性症を介して膜に固定されていることを和らげます。部分。トリトンX-114の位相分離によって推定されるように、オクチルグルコシドはアミノペプチダーゼPの両親媒性型を可溶化しましたが、PI-PLCリリースされた型は親水性特性を示しました。対照的に、2つの微小型カルボキシペプチダーゼの洗剤可溶化のパターンと、細菌PI-PLCによる膜からの放出に対する耐性は、これら2つのエクトエンザイムがホスファチジルイノシトールを介して固定されていないことを示唆しています。
The mode of membrane anchorage of three kidney microvillar membrane ectoenzymes has been examined. The release of aminopeptidase P (EC 3.4.11.9) from kidney membranes by bacterial phosphatidylinositol-specific phospholipase C (PI-PLC) and the pattern of detergent solubilization of this ectoenzyme implies that it is anchored to the membrane via a covalently attached glycosyl-phosphatidylinositol moiety. As deduced by phase separation in Triton X-114, octyl-glucoside solubilized the amphipathic form of aminopeptidase P, whereas the PI-PLC-released form displayed hydrophilic properties. In contrast, the pattern of detergent solubilization of two microvillar carboxypeptidases and their resistance to release from the membrane by bacterial PI-PLC suggest that these two ectoenzymes are not anchored via phosphatidylinositol.
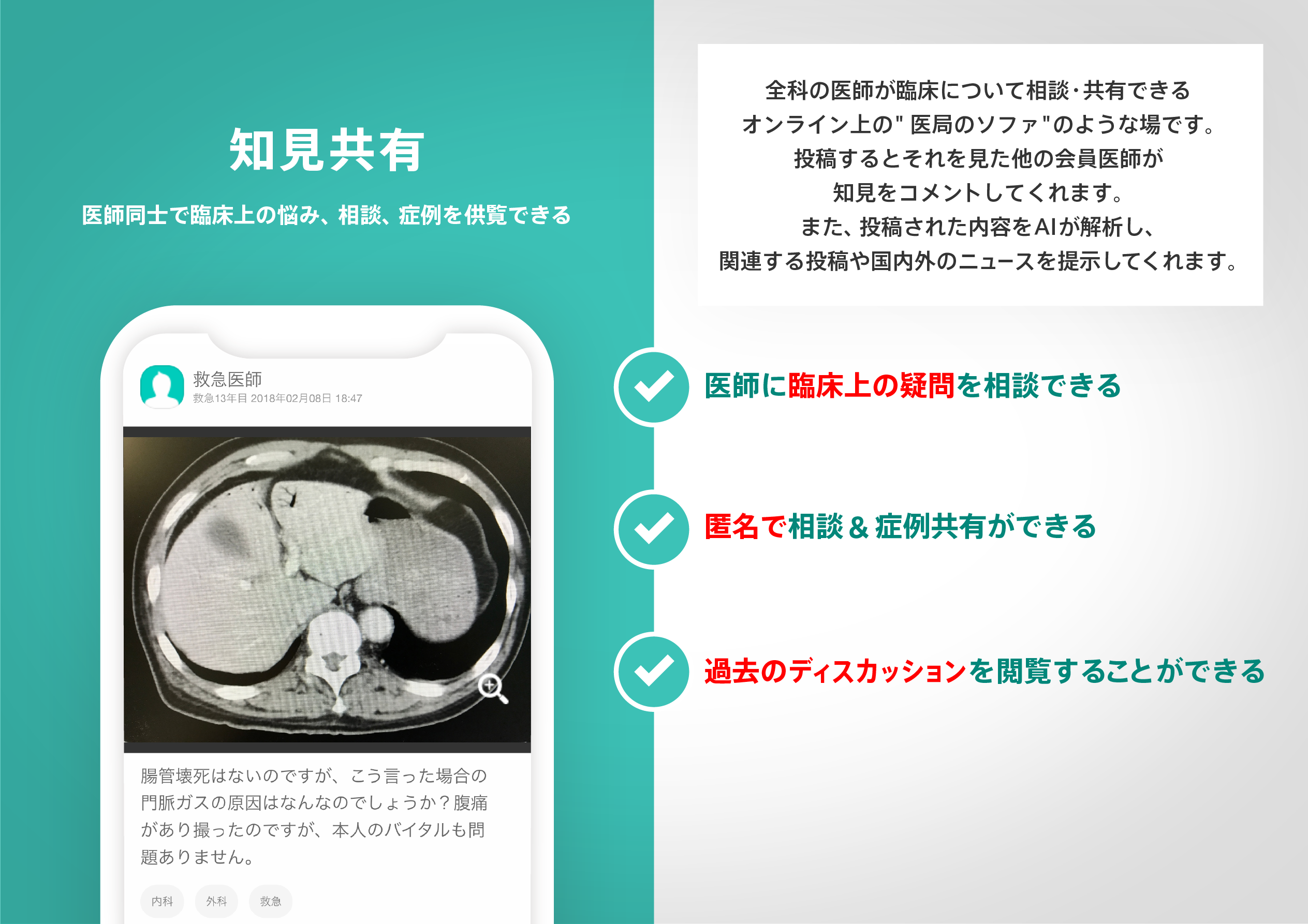
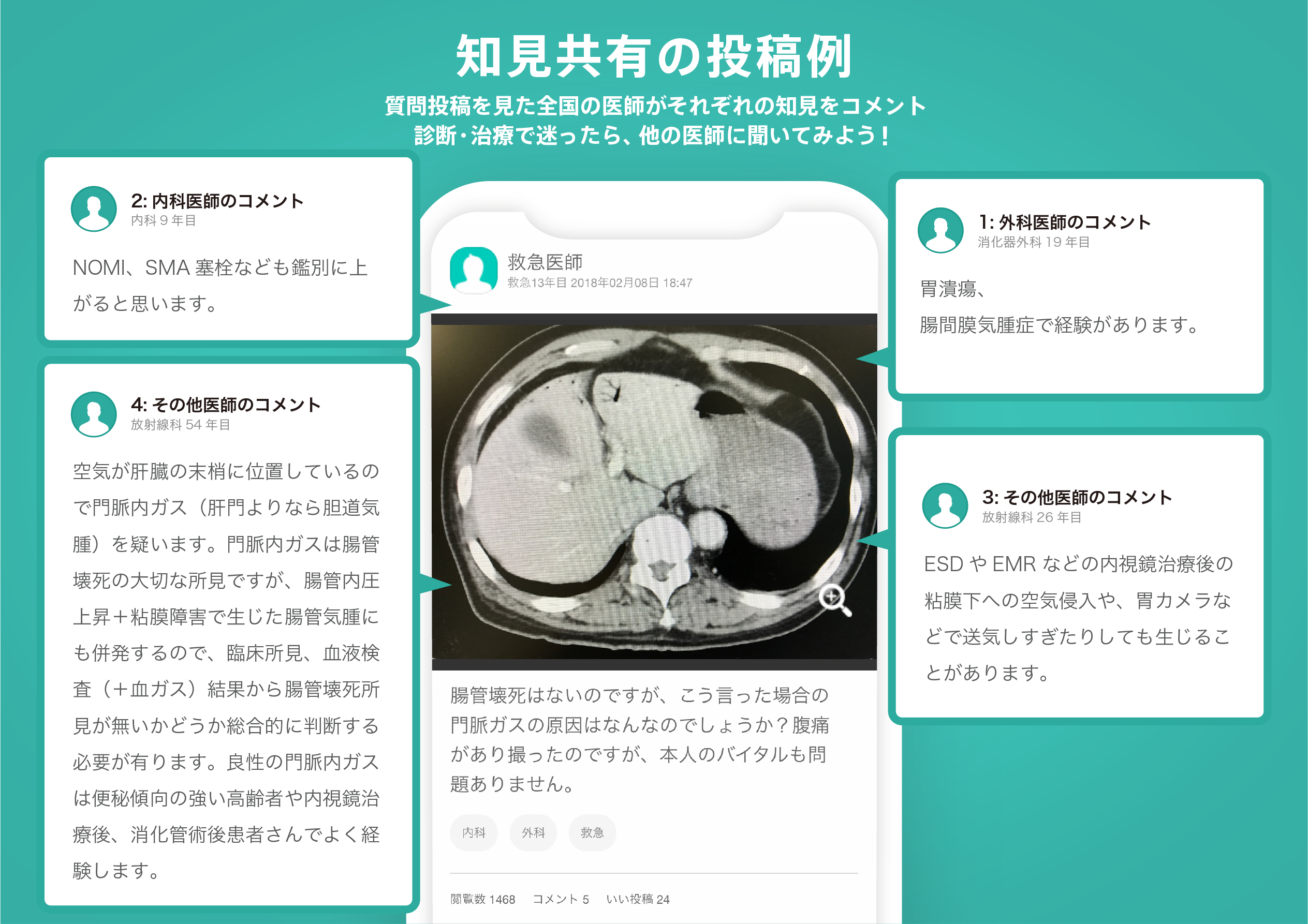
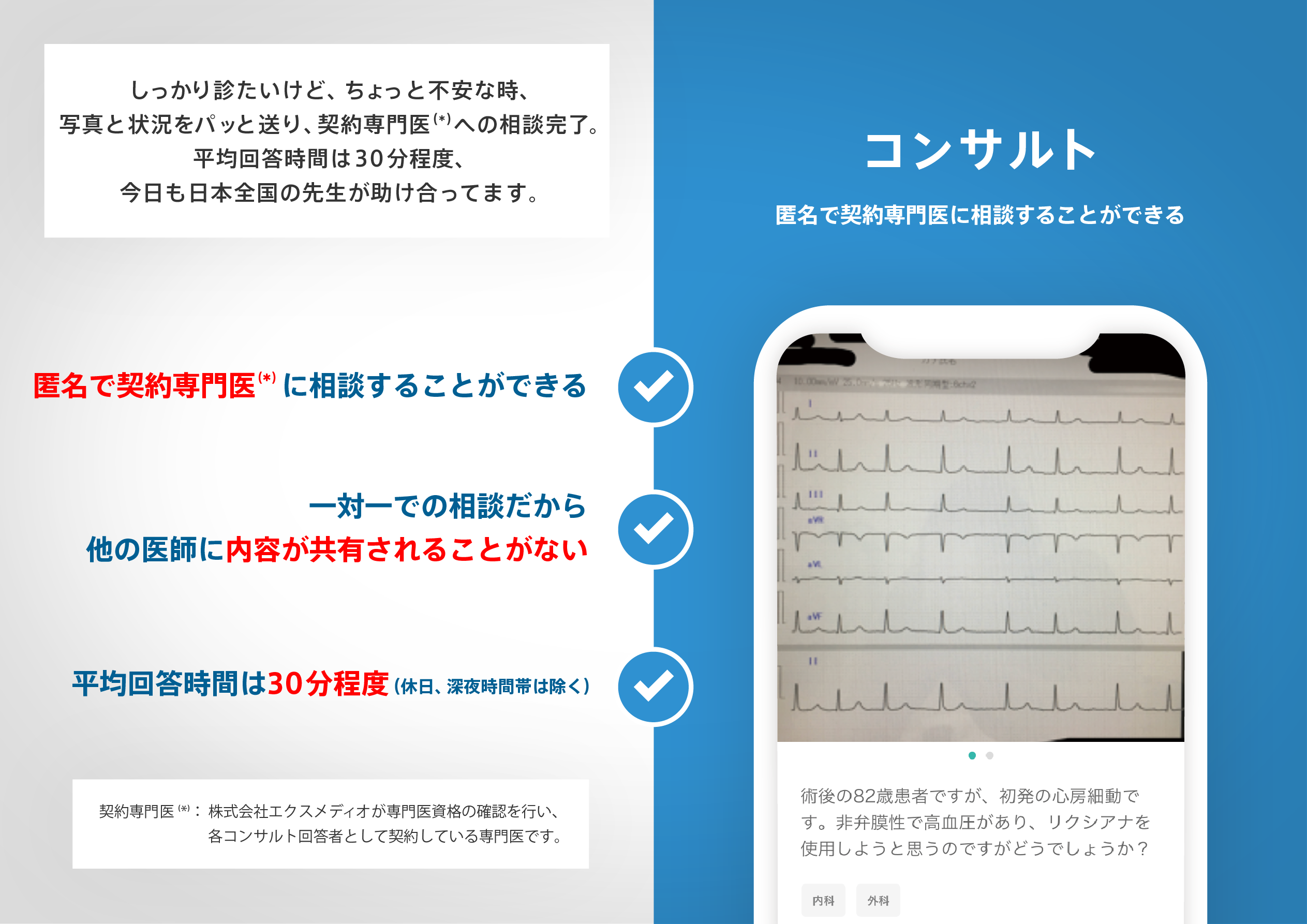
医師のための臨床サポートサービス
ヒポクラ x マイナビのご紹介
無料会員登録していただくと、さらに便利で効率的な検索が可能になります。